Promieniowanie charakterystyczne
Wygląd przypnij ukryj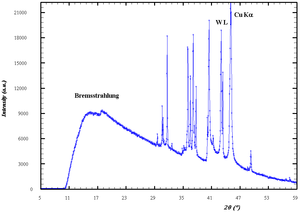 Widmo promieniowania rentgenowskiego dla antykatody zawierającej miedź. Widmo składa się ciągłego widma hamowania i linii promieniowania charakterystycznego.
Widmo promieniowania rentgenowskiego dla antykatody zawierającej miedź. Widmo składa się ciągłego widma hamowania i linii promieniowania charakterystycznego.
 Schemat emisji promieniowania charakterystycznego
Schemat emisji promieniowania charakterystycznego
Promieniowanie charakterystyczne – linie spektralne atomów charakterystyczne dla danego pierwiastka, powstające po wybiciu elektronu z wewnętrznej powłoki elektronowej i następującego po tym przejściu innego elektronu z powłoki wyższej na zwolnione miejsce. Po wybiciu elektronu z powłoki wewnętrznej (np. K lub L) atom ma większą energię, niż gdy ma wypełnione powłoki. Elektron przechodząc na poziom o mniejszej energii, może utracić ją w wyniku promieniowania elektromagnetycznego o energii równej różnicy energii między tymi poziomami.
Linię promieniowania charakterystycznego oznacza się według powłoki, na którą przechodzi elektron, oraz powłoki, z której przechodzi elektron. Rozpowszechnione są dwie notacje linii promieniowania charakterystycznego: notacja Siegbahna oraz notacja IUPAC.
| Powłoka, na którą przechodzi elektron | Powłoki, z której przechodzi elektron | Notacja Siegbahna | Notacja IUPAC |
|---|---|---|---|
| 1 s 1 / 2 {\displaystyle 1s_{1/2}} | 2 p 3 / 2 {\displaystyle 2p_{3/2}} | K α 1 {\displaystyle K\alpha _{1}} | K − L 3 {\displaystyle K-L_{3}} |
| 1 s 1 / 2 {\displaystyle 1s_{1/2}} | 2 p 1 / 2 {\displaystyle 2p_{1/2}} | K α 2 {\displaystyle K\alpha _{2}} | K − L 2 {\displaystyle K-L_{2}} |
| 1 s 1 / 2 {\displaystyle 1s_{1/2}} | 3 p 3 / 2 {\displaystyle 3p_{3/2}} | K β 1 {\displaystyle K\beta _{1}} | K − M 3 {\displaystyle K-M_{3}} |
| 1 s 1 / 2 {\displaystyle 1s_{1/2}} | 4 p {\displaystyle 4p} | K β 2 {\displaystyle K\beta _{2}} | K − N 2 , 3 {\displaystyle K-N_{2,3}} |
| 1 s 1 / 2 {\displaystyle 1s_{1/2}} | 3 p 1 / 2 {\displaystyle 3p_{1/2}} | K β 3 {\displaystyle K\beta _{3}} | K − M 2 {\displaystyle K-M_{2}} |
| 2 p 3 / 2 {\displaystyle 2p_{3/2}} | 3 d 5 / 2 {\displaystyle 3d_{5/2}} | L α 1 {\displaystyle L\alpha _{1}} | L 3 − M 5 {\displaystyle L_{3}-M_{5}} |
| 2 p 3 / 2 {\displaystyle 2p_{3/2}} | 3 d 3 / 2 {\displaystyle 3d_{3/2}} | L α 2 {\displaystyle L\alpha _{2}} | L 3 − M 4 {\displaystyle L_{3}-M_{4}} |
| 2 p 1 / 2 {\displaystyle 2p_{1/2}} | 3 d 3 / 2 {\displaystyle 3d_{3/2}} | L β 1 {\displaystyle L\beta _{1}} | L 2 − M 4 {\displaystyle L_{2}-M_{4}} |
| 3 d 5 / 2 {\displaystyle 3d_{5/2}} | 4 f 7 / 2 {\displaystyle 4f_{7/2}} | M α 1 {\displaystyle M\alpha _{1}} | M 5 − N 7 {\displaystyle M_{5}-N_{7}} |
| 3 d 5 / 2 {\displaystyle 3d_{5/2}} | 4 f 5 / 2 {\displaystyle 4f_{5/2}} | M α 2 {\displaystyle M\alpha _{2}} | M 5 − N 6 {\displaystyle M_{5}-N_{6}} |
| 3 d 3 / 2 {\displaystyle 3d_{3/2}} | 4 f 5 / 2 {\displaystyle 4f_{5/2}} | M β 1 {\displaystyle M\beta _{1}} | M 4 − N 6 {\displaystyle M_{4}-N_{6}} |
Energie linii promieniowania charakterystycznego pierwiastków można znaleźć w bazie NIST X-Ray Transition Energies Database.
Dla pierwiastków ciężkich promieniowanie charakterystyczne jest promieniowaniem rentgenowskim. Powstaje tylko wtedy, gdy napięcie między katodą a anodą w lampie rentgenowskiej przekroczy tzw. napięcie wzbudzenia, umożliwiające wybicie elektronu z głębszych powłok.
Za odkrycie promieniowania charakterystycznego fizyk brytyjski Charles Glover Barkla w 1917 roku otrzymał Nagrodę Nobla w dziedzinie fizyki.
Przypisy
- ↑ Partviii
- ↑ NIST X-Ray Transition Energies Database
- ↑ Bojarski Z., Łągiewka E., Rentgenowska analiza strukturalna, Wyd. II poprawione i poszerzone, Katowice: Wyd. Uniwersytetu Śląskiego 1995, ISSN 0239-6432.































