Azotan miedzi(II)
W dzisiejszym świecie Azotan miedzi(II) odgrywa fundamentalną rolę w naszym społeczeństwie. Z czasem Azotan miedzi(II) stał się istotnym elementem naszego życia, wywierając ogromny wpływ na nasze codzienne życie. Niezależnie od tego, czy na poziomie osobistym, zawodowym czy społecznym, Azotan miedzi(II) zdołał wpłynąć na sposób, w jaki myślimy, działamy i odnosimy się do otaczającego nas świata. W tym artykule zbadamy znaczenie Azotan miedzi(II) i jego znaczenie w różnych aspektach naszego codziennego życia. Od wpływu Azotan miedzi(II) na zdrowie po wpływ na gospodarkę światową, Azotan miedzi(II) to temat, którego nie możemy zignorować.
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||
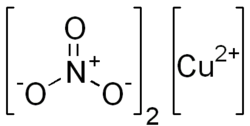
| Wzór sumaryczny |
Cu(NO3)2 | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
Cu(NO3)2 – 187,57 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
zielononiebieskie kryształy (bezwodny) lub niebieskie kryształy (uwodniony)[1][2] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS |
3251-23-8 (bezwodny) | ||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||||||||||||||||||||||||||
| Inne kationy | |||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||
Azotan miedzi(II), Cu(NO3)2 – nieorganiczny związek chemiczny, sól kwasu azotowego i miedzi. Postać bezwodna tworzy niebiesko-zielone kryształy i sublimuje w próżni w temperaturze 150–200 °C[6].
Właściwości
Tworzy formy uwodnione Cu(NO
3)
2·xH
2O, gdzie x = 2,5, 3 lub 6. Sześciowodzian (heksahydrat) łatwo traci wodę w temp. 25 °C dając Cu(NO
3)·3H
2O. Bezwodny Cu(NO
3)
2 jest otrzymywany z Cu oraz N
2O
4 zgodnie z reakcją
- Cu + 3N
2O
4 → + 2NO
w obecności katalizatora MeCN, po której następuje rozkład [Cu(NO
3)
2 do Cu(NO
3)
2[7]. Próba dehydratacji dowolnego uwodnionego azotanu miedzi(II) przez ogrzewanie prowadzi jednak do tlenków, a nie Cu(NO
3)
2. W temp. 80 °C hydrat przekształca się bowiem w zasadowy azotan miedzi(II), Cu
2(NO
3)(OH)
3, który po podgrzaniu do 180 °C daje CuO[2].
Otrzymywanie
Azotan miedzi można otrzymać np.:
- w reakcji kwasu azotowego z miedzią[2]:
- ze stężonym kwasem azotowym: Cu + 4HNO
3 → Cu(NO
3)
2 + 2NO
2↑ + 2H
2O - z rozcieńczonym, zimnym kwasem azotowym: 3Cu + 8HNO
3 → 3Cu(NO
3)
2 + 2NO↑ + 4H
2O
- w reakcji kwasu azotowego z tlenkiem miedzi lub węglanem miedzi
- w procesie elektrolizy azotanu amonu z użyciem elektrody miedzianej.
W warunkach standardowych uwodniony azotan miedzi jest niebieskim, krystalicznym ciałem stałym. Rozpuszcza się w wodzie. Roztwór ma odczyn kwasowy.
Zastosowanie
Stosowany jest m.in. do barwienia ceramiki, nabłyszczania żelaza, produkcji papieru światłoczułego, jako utleniacz w paliwach rakietowych i w pirotechnice[2].
Przypisy
- ↑ a b c d e Pradyot Patnaik: Handbook of Inorganic Chemicals. The McGraw-Hill Companies, 2003, s. 269–271. ISBN 0-07-049439-8.
- ↑ a b c d H. Wayne Richardson: Copper Compounds. W: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim, 2005. DOI: 10.1002/14356007.a07_567.
- ↑ a b c Department of Chemistry, The University of Akron: Cupric nitrate. . (ang.).
- ↑ a b Azotan miedzi(II), hydrat (nr 229636) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- ↑ CRC Handbook of Chemistry and Physics. Wyd. 83. Boca Raton: CRC Press, 2003, s. 4-23.
- ↑ Pass, Sutcliffe: Practical Inorganic Chemistry. London: Chapman and Hall, 1968.
- ↑ C. Housecroft, E. Sharpe: Inorganic Chemistry. Pearson Prentice Hall, 2005 (wydanie II), s. 636. ISBN 0130-39913-2.


