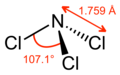Trichlorek azotu
Obecnie Trichlorek azotu jest tematem o ogromnym znaczeniu we współczesnym społeczeństwie. Jego wpływ rozciąga się na różne obszary życia codziennego, od polityki po technologię, kulturę i ekonomię. W tym artykule zagłębiamy się w świat Trichlorek azotu, badając jego liczne aspekty i wpływ na nasze codzienne życie. Poprzez szczegółową analizę postaramy się rzucić światło na różne aspekty, które sprawiają, że Trichlorek azotu jest istotnym tematem wartym dzisiejszego przestudiowania. Od wpływu na życie ludzi po wpływ na środowisko globalne, Trichlorek azotu jest zjawiskiem zasługującym na dogłębne zbadanie.
| |||||||||||||||||||||||||

| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny |
NCl3 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
Cl3N | ||||||||||||||||||||||||
| Masa molowa |
120,36 g/mol | ||||||||||||||||||||||||
| Wygląd |
żółta, oleista ciecz[1] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
Trichlorek azotu, NCl
3 – nieorganiczny związek chemiczny z grupy halogenków azotu. Związek ten może też być traktowany jako pochodna amoniaku, w której wszystkie atomy wodoru zostały podstawione atomami chloru, stąd alternatywna nazwa trichloroamina. Jest silnie wybuchowy[3]. Powstaje m.in. w reakcji chloru z amoniakiem i stanowi istotne zagrożenie w instalacjach przemysłowych z chlorem – dla uniknięcia jego powstawania, konieczne jest zapewnienie braku kontaktu chloru ze związkami amonowymi[4].
Otrzymywanie
Po raz pierwszy został otrzymany w roku 1811 przez francuskiego chemika P. L. Dulonga. Zarówno on, jak i Humphry Davy oraz Michael Faraday odnieśli obrażenia w wyniku eksplozji podczas badań tego związku (Dulong stracił 3 palce)[5].
Typową metodą otrzymywania trichlorku azotu jest reakcja chloru z amoniakiem lub solami amonowymi[3][6]:
- NH
3 + 3Cl
2 → NCl
3 + 3HCl
Na skalę laboratoryjną związek ten można otrzymać przez elektrolizę nasyconego roztworu chlorku amonu – chlor wydzielający się na anodzie, reaguje z solą amonową[5]:
- NH
4Cl + 3Cl
2 → NCl
3 + 4HCl
Szkodliwość
Trichlorek azotu powstaje podczas dezynfekcji związkami chloru wody zanieczyszczonej substancjami zawierającymi azot (np. mocznikiem, jonami NH+
4 lub aminokwasami)[7] i jest główną przyczyną ostrego zapachu na pływalniach krytych[8]. Powoduje podrażnienia oczu i układu oddechowego oraz może wywoływać astmę[7]. W celu jego rozkładu można stosować naświetlanie światłem UV o λ ≈ 360 nm[8].
Przypisy
- ↑ a b c d e f David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-79, ISBN 978-1-4200-9084-0 (ang.).
- ↑ David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 9-51, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b Yasukazu Ura, Gozyo Sakata: Chloroamines. W: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley, s. 1–2.
- ↑ Peter Schmittinger: Chlorine. W: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley, s. 6, 71–80.
- ↑ a b Stanisław Tołłoczko, Wiktor Kemula: Chemia nieorganiczna z zasadami chemii ogólnej. Warszawa: PWN, 1954, s. 315.
- ↑ Handbook of Preparative Inorganic Chemistry. Georg Brauer (red.). Wyd. 2. T. 1. Nowy Jork, Londyn: Academic Press, 1963, s. 479.
- ↑ a b C. Schmalz, F.H. Frimmel, C. Zwiener. Trichloramine in swimming pools--formation and mass transfer. „Water Res”. 45 (8), s. 2681–2690, 2011. DOI: 10.1016/j.watres.2011.02.024. PMID: 21420139.
- ↑ a b Światło UV. Pływalnie i baseny. .