Czynnik IX
W tym artykule zajmiemy się tematem Czynnik IX, który przykuł uwagę milionów ludzi na całym świecie. Czynnik IX to temat, który wzbudził duże zainteresowanie ze względu na jego znaczenie w życiu codziennym, wpływ na społeczeństwo i znaczenie w różnych obszarach. W tym artykule szczegółowo zbadamy Czynnik IX, badając jego pochodzenie, ewolucję w czasie i wpływ na różne aspekty życia. Od jego wpływu na popkulturę po rolę w historii, Czynnik IX to temat, który zasługuje na dokładne przestudiowanie. Dzięki podejściu multidyscyplinarnemu przeanalizujemy różne aspekty Czynnik IX i jego wpływ na współczesny świat. Przygotuj się na zanurzenie w fascynującym świecie Czynnik IX i odkryj wszystko, co ten motyw ma do zaoferowania!
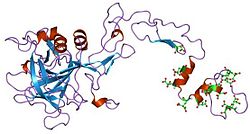
Czynnik IX (czynnik Christmasa) (EC 3.4.21.22) – enzym z grupy proteaz serynowych zaangażowany w proces krzepnięcia krwi; należy do rodziny peptydaz S1. Chorobą związaną z niedoborem tego białka jest hemofilia B. Niedobór tego białka prowadzący do hemofilii został odkryty u młodego chłopca Stephena Christmasa w 1952 roku[1].
Fizjologia
Czynnik IX jest wytwarzany jako proenzym. Następnie dochodzi do usunięcia peptydu sygnałowego, glikozylacji oraz cięcia przez czynnik XIa (w szlaku wewnętrznym) bądź czynnik VIIa (w szlaku zewnętrznym), w wyniku czego powstaje dwułańcuchowa struktura, której łańcuchy są połączone mostkiem disiarczkowym[2][3]. Po aktywacji do czynnika IXa, w obecności jonów Ca2+, fosfolipidów błonowych oraz czynnika VIII jako kofaktora, hydrolizuje wiązanie pomiędzy argininą a izoleucyną w strukturze czynnika X wytwarzając czynnik Xa.
Inhibitorem czynnika IX jest antytrombina[2].
Ekspresja czynnika IX wzrasta wraz z wiekiem u ludzi i myszy. W badaniach na modelach mysich wykazano, że fenotyp mutacji w obrębie promotora czynnika IX jest zależny od wieku[4].
Struktura białka
Czynniki VII, IX i X odgrywają kluczową rolę w krzepnięciu krwi oraz charakteryzują się podobną strukturą białkową[5]. Czynnik IX jest białkiem zbudowanym z 4 domen. Są to: domena Gla, dwie tandemowe kopie domeny podobnej do EGF i C-końcowa domena peptydazy trypsynopodobnej, która wykonuje cięcie katalityczne.
Wykazano, że N-końcowa domena podobna do EGF odpowiada za wiązanie z czynnikiem tkankowym[5]. Wilkinson i wsp. stwierdzili, że pozostałe 88–109 aminokwasów drugiej domeny podobnej do EGF pośredniczy w wiązaniu płytek krwi oraz w przyłączaniu do kompleksu aktywującego czynnik X[6].
Struktura wszystkich czterech domen została poznana. Strukturę dwóch domen podobnych do EGF oraz domeny trypsynopodobnej określono na podstawie białka świni[7]. Struktura domeny Gla, która jest odpowiedzialna za zależne od jonów wapnia wiązanie fosfolipidów została określona za pomocą NMR[8].
Zostało poznanych kilka struktur "superaktywnych" mutantów[9], które potwierdzają, że aktywacja czynnika IX zachodzi dzięki innymi białkom zaangażowanym w kaskadę krzepnięcia.
Lokalizacja genu czynnika IX
Gen kodujący czynnik IX jest zlokalizowany na chromosomie X (Xq27.1-q27.2); dziedziczenie recesywne sprzężone z chromosomem X: mutacje tego genu częściej dotyczą mężczyzn niż kobiet. Został po raz pierwszy sklonowany przez Kotoku Kurachiego i Earla Daviego w 1982 roku[10].
Polly, transgeniczna owca rasy Poll Dorset, sklonowana przez Iana Wilmuta w Instytucie Roslin w 1997 roku miała gen czynnika IX[11].
Rola w patologii
Niedobór czynnika IX powoduje chorobę Christmasa (hemofilię B)[1]. Opisano ponad 100 mutacji czynnika IX; niektóre z nich są bezobjawowe, ale wiele prowadzi do występowania poważnych zaburzeń krzepnięcia i krwawień. Typowa mutacja w chorobie Christmasa została zidentyfikowana przez sekwencjonowanie, odkryto mutację zmieniającą cysteinę na serynę[12].
Do leczenia choroby Christmasa wykorzystuje się rekombinowany czynnik IX, komercyjnie dostępny pod nazwą Benefix[13]. Niektóre rzadkie mutacje czynnika IX mogą powodować jego zwiększoną aktywność w procesie krzepnięcia i powodować choroby zakrzepowe, takie jak zakrzepica żył głębokich[14].
Niedobór czynnika IX jest leczony przy zastosowaniu zastrzyków z oczyszczonego czynnika IX produkowanego w wyniku klonowania w różnych komórkach zwierzęcych. Kwas traneksamowy może być z powodzeniem stosowany u pacjentów z niedoborem czynnika IX, u których planowana jest operacja, w celu zmniejszenia ryzyka krwawień w czasie okołooperacyjnym[15].
Wykaz wszystkich mutacji czynnika IX jest przechowywany w bazie danych mutacji czynnika IX[16] w University College London.
Zobacz też
Przypisy
- ↑ a b R Biggs i inni, Christmas Disease, „British Medical Journal”, 4799, 2, 1952, s. 1378–1382, DOI: 10.1136/bmj.2.4799.1378, PMID: 12997790, PMCID: PMC2022306.
- ↑ a b Di Scipio RG, Kurachi K, Davie EW. Activation of human factor IX (Christmas factor). „J. Clin. Invest.”. 61 (6), s. 1528–1538, 1978. DOI: 10.1172/JCI109073. PMID: 659613. PMCID: PMC372679.
- ↑ Taran LD. Factor IX of the blood coagulation system: a review. „Biochemistry Mosc.”. 62 (7), s. 685–693, 1997. PMID: 9331959.
- ↑ Boland EJ, Liu YC, Walter CA, Herbert DC, Weaker FJ, Odom MW, Jagadeeswaran P. Age-specific regulation of clotting factor IX gene expression in normal and transgenic mice. „Blood”. 86 (6), s. 2198–2205, 1995. PMID: 7662969.
- ↑ a b Zhong D, Bajaj MS, Schmidt AE, Bajaj SP. The N-terminal epidermal growth factor-like domain in factor IX and factor X represents an important recognition motif for binding to twydanie factor. „J. Biol. Chem.”. 277 (5), s. 3622–3631, 2002. DOI: 10.1074/jbc.M111202200. PMID: 11723140.
- ↑ Wilkinson FH, Ahmad SS, Walsh PN. The factor IXa second epidermal growth factor (EGF2) domain mediates platelet binding and assembly of the factor X activating complex. „J. Biol. Chem.”. 277 (8), s. 5734–5741, 2002. DOI: 10.1074/jbc.M107753200. PMID: 11714704.
- ↑ Brandstetter H, Bauer M, Huber R, Lollar P, Bode W. X-ray structure of clotting factor IXa: active site and module structure related to Xase activity and hemophilia B. „Proc. Natl. Acad. Sci. U.S.A.”. 92 (21), s. 9796–9800, 1995. DOI: 10.1073/pnas.92.21.9796. PMID: 7568220. PMCID: PMC40889.
- ↑ Freedman SJ, Furie BC, Furie B, Baleja JD. Structure of the calcium ion-bound γ-carboxyglutamic acid-rich domain of factor IX. „Biochemistry”. 34 (38), s. 12126–12137, 1995. DOI: 10.1021/bi00038a005. PMID: 7547952.
- ↑ Zogg T, Brandstetter H,. Structural Basis of the Cofactor- and Substrate-Assisted Activation of Human Coagulation Factor IXa. „Structure”. 17 (12), s. 1669–1678, 2009. DOI: 10.1016/j.str.2009.10.011. PMID: 20004170.
- ↑ Kurachi K, Davie E. Isolation and characterization of a cDNA coding for human factor IX. „Proc Natl Acad Sci USA”. 79 (21), s. 6461–6464, 1982. DOI: 10.1073/pnas.79.21.6461. PMID: 6959130. PMCID: PMC347146.
- ↑ Nicholl D.: An Introduction to Genetic Engineering. Wyd. 2. Cambridge University Press, 2002, s. 257. ISBN 978-0-521-00471-8.
- ↑ SA. Taylor, J. Duffin, C. Cameron, J. Teitel i inni. Characterization of the original Christmas disease mutation (cysteine 206→serine): from clinical recognition to molecular pathogenesis. „Thromb Haemost”. 67 (1), s. 63-65, 1992. PMID: 1615485.
- ↑ BeneFIX Coagulation Factor IX (Recombinant) Official Site.
- ↑ Simioni P, Tormene D, Tognin G, Gavasso S, Bulato C, Iacobelli NP, Finn JD, Spiezia L, Radu C, Arruda VR. X-linked thrombophilia with a mutant factor IX (factor IX Padua). „N. Engl. J. Med.”. 361 (17), s. 1671–1675, 2009. DOI: 10.1056/NEJMoa0904377. PMID: 19846852.
- ↑ Rossi M, Jayaram R, Sayeed R. Do patients with haemophilia undergoing cardiac surgery have good surgical outcomes?. „Interact Cardiovasc Thorac Surg”. 13 (3), s. 320–331, 2011. DOI: 10.1510/icvts.2011.272401. PMID: 21712351.
- ↑ Factor IX Mutation Database. www.factorix.org. .
Linki zewnętrzne
- GeneReviews/NCBI/NIH/UW entry on Hemophilia B
- The MEROPS online database for peptidases and their inhibitors: S01.214
- Christmas factor - a human protein involved in blood clotting. PDBe Protein Data Bank in Europe . . .